Voy a continuar con la serie de entradas dedicadas al patrimonio metálico que comencé en noviembre hablando de los procesos redox. En esa entrada comentaba que los procesos redox se basaban en
intercambios de electrones entre distintas sustancias que se oxidaban o
reducían en función de que cediesen (oxidación) o ganasen (reducción) electrones. El que una
sustancia sea la que ceda y otra la que acepte, es decir, la dirección
del flujo de electrones depende de la espontaneidad de la reacción. El que una reacción sea espontánea quiere decir que evoluciona de manera natural hacia un estado energético más estable. La forma de medir la espontaneidad de una reacción es mediante la energía libre de Gibbs y se representa gráficamente de la siguiente forma:
Por tanto, un proceso es espontáneo si la variación de la enegría libre de Gibbs es negativa (ΔG<0).
La espontaneidad de un proceso redox se mide mediante los potenciales de reducción estándar. Estos potenciales son unos valores que indican la tendencia a adquirir electrones de distintas especies. En un proceso redox la especie con un mayor potencial de reducción se reducirá y, por tanto, la otra se oxidará.
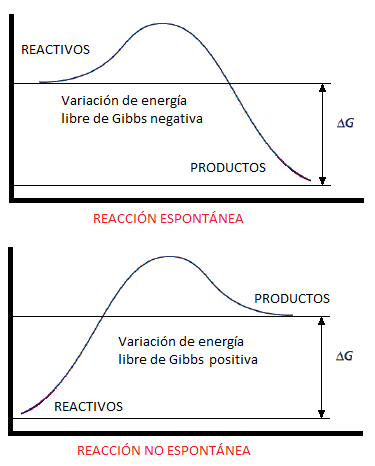 |
| Procesos espontáneos y no espontáneos (quimitube.com) |
Por tanto, un proceso es espontáneo si la variación de la enegría libre de Gibbs es negativa (ΔG<0).
La espontaneidad de un proceso redox se mide mediante los potenciales de reducción estándar. Estos potenciales son unos valores que indican la tendencia a adquirir electrones de distintas especies. En un proceso redox la especie con un mayor potencial de reducción se reducirá y, por tanto, la otra se oxidará.
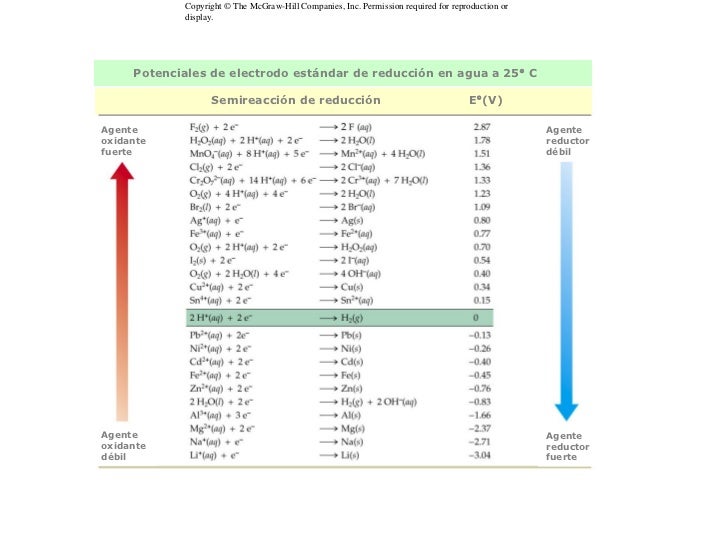 |
| Tabla de potenciales de reducción estándar |
Aquí vemos un ejemplo:
 |
| Ejemplo de reacción redox |
El potencial de reducción estándar de una reacción y la energía libre de Gibbs se relacionan mediante la ecuación de Nernst. Esta ecuación viene a decir que el potencial de reducción estándar es proporcional a -ΔG. Por lo tanto, el signo positivo del potencial de la reacción global indica que será espontánea.
No hay comentarios:
Publicar un comentario